Call us now:
26 de junio de 2025
– Nuevos datos de un estudio abierto en Becker demostraron estabilización sostenida de la enfermedad por hasta tres años en los participantes, lo que refuerza los hallazgos clínicos previos –
– Ensayo pivotal en curso y una reunión Tipo C con la FDA proporcionaron una vía clara hacia el posible registro de sevasemten como la primera terapia para Becker –
– Observaciones alentadoras de Fase 2 en Duchenne definen la dosis e informan el diseño para Fase 3 –
– Líderes de Edgewise comentarán estas actualizaciones el jueves 26 de junio a las 8:30 a.m. (hora del Este) en un evento virtual de inversores –
BOULDER, Colorado, 26 de junio de 2025 / PRNewswire / – Edgewise Therapeutics, Inc., (Índice Nasdaq: EWTX), una compañía biofarmacéutica líder en enfermedades musculares reveló hoy resultados positivos de su programa sevasemten para las distrofias musculares de Becker y Duchenne.
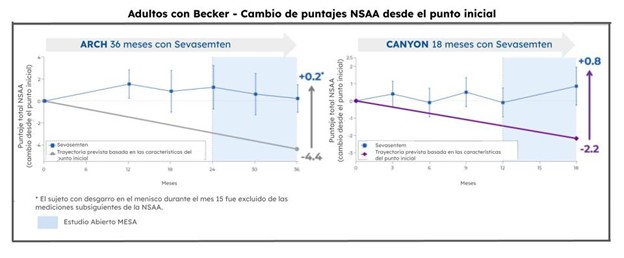
La Compañía anunció datos positivos de MESA, un ensayo de extensión abierto que proporciona acceso continuo de sevasemten a los participantes con Becker, quienes previamente se habían inscrito a ARCH, o habían completado CANYON, GRAND CANYON, o DUNE. Hasta el corte de datos de marzo de 2025, 99% de los participantes elegibles (n=85) se inscribieron a MESA.
Los datos de MESA demostraron estabilización sostenida de la enfermedad, lo que refuerza los hallazgos previos de ARCH y CANYON. De manera importante, los participantes de CANYON que pasaron a MESA mostraron puntajes incrementados en la Escala Ambulatoria North Star (NSAA, por sus siglas en inglés) a lo largo de 18 meses (0.8 puntos de mejora desde el valor inicial), con una tendencia hacia una mejora en participantes con placebo que cambiaron a sevasemten (0.2 puntos de mejora desde que iniciaron con sevasemten). Durante los 18 meses de tratamiento con sevasemten, los puntajes NSAA de los participantes continuaron separándose, en comparación con los deterioros funcionales esperados observados en varios estudios de historia natural de Becker. Además, los puntajes NSAA de los participantes de ARCH que pasaron a MESA se mantuvieron estables luego de tres años de tratamiento. Sevasemten continúa demostrando un perfil de seguridad favorable después de hasta tres años de tratamiento.
“Estamos muy entusiasmados por la emoción tan grande de parte de los médicos y la comunidad de pacientes en torno a los datos sobre sevasemten a la fecha, y su firme compromiso con nuestro programa pivotal en curso,” dijo Joanne Donovan, quien es Doctora, Doctora en Medicina, y Directora Médica. “Estamos en buena posición de ofrecer la primera terapia para personas con distrofia muscular de Becker.”
Recientemente Edgewise tuvo una exitosa reunión Tipo C con la Administración de Alimentos y Medicamentos de EE. UU. (FDA, por sus siglas en inglés), lo cual proporcionó una vía clara hacia el registro de sevasemten como la primera terapia para Becker. Aunque la FDA consideró los datos de CANYON por sí solos como insuficientes para una aprobación acelerada, la Agencia reiteró que la NSAA es un parámetro clínicamente significativo para una aprobación tradicional. La FDA alentó a Edgewise a continuar compartiendo datos de MESA y modelos prospectivos de historia natural antes de la finalización de GRAND CANYON. Además, la FDA enfatizó su apoyo a GRAND CANYON, la cohorte pivotal global controlada con placebo en curso, y su potencial como un estudio único adecuado y bien controlado para respaldar el registro. GRAND CANYON tiene un alto poder para mostrar una diferencia estadísticamente significativa en la NSAA frente al placebo de 18 meses, y está listo, según lo planeado, para dar datos importantes en el cuarto trimestre de 2026.
La Compañía anunció también datos importantes alentadores de sus ensayos de Fase 2 en Duchenne, LYNX y FOX. Los objetivos eran explorar un rango de dosis para evaluar la seguridad e identificar una dosis potencialmente beneficiosa para la Fase 3. El paradigma escalonado de dosis del ensayo brindó un periodo de control con placebo de tres meses para evaluar los biomarcadores para selección de dosis, tras un periodo abierto. A lo largo de ambos estudios, con las dosis objetivo, sevasemten fue bien tolerado.
LYNX es un ensayo de Fase 2 en curso, en diferentes centros, controlado con placebo, que determina la dosis para evaluar el efecto de sevasemten en la seguridad, biomarcadores de daño muscular y función en participantes de entre 4 a 9 años de edad con Duchenne. Estos fueron tratados con sevasemten en un estudio controlado con placebo por tres meses para determinar la dosis. Las observaciones consistentes a través de las medidas funcionales, incluyendo la velocidad de zancada en el percentil 95 (SV95C, por sus siglas en inglés), la NSAA y la prueba de subida de 4 escalones, identificaron una dosis de 10 mg a evaluar en la Fase 3.
Similar al diseño de LYNX, FOX es un ensayo de Fase 2 en curso, en diferentes centros, controlado con placebo para evaluar el efecto de sevasemten en la seguridad, los biomarcadores de daño muscular y la función en participantes de entre 6 a 14 años de edad con Duchenne que han sido previamente tratados con terapia génica. Los participantes de FOX tienen en promedio más de 10 años de edad, y han pasado cuatro años desde que recibieron la terapia génica. A pesar de la falta de historia natural extensiva en niños con Duchenne tratados con terapia génica, los resultados iniciales del estudio FOX indican que sevasemten de 10 mg tiene el potencial para reducir la tasa de deterioro funcional.
“Hemos llevado a cabo una exploración importante de Fase 2 de sevasemten en Duchenne,” dijo Kevin Kitsch, Doctor, Presidente y Director General. “Nos motiva la respuesta funcional vista con la dosis de 10 mg y esperamos conversar con la Agencia más adelante este mismo año.”
La Compañía planea reunirse con la FDA en el cuarto trimestre de 2025 para conversar sobre el diseño de la Fase 3, incluyendo información sobre la población de pacientes y objetivos, con planes de iniciar el estudio pivotal en 2026. Además, la Compañía planea continuar recopilando datos a un plazo más largo de la extensión abierta del estudio, lo cual ofrecerá más acceso al medicamento para los participantes del ensayo.
Evento de inversores virtual
Miembros del equipo directivo de Edgewise llevarán a cabo una transmisión en vivo el jueves 26 de junio, a las 8:30 a.m. (hora del Este), para dialogar sobre el programa sevasemten. Una presentación de diapositivas estará también disponible. Para registrarse a la transmisión en vivo y ver la grabación, por favor visite la página de eventos de Edgewise.
Sobre Sevasemten
Sevasemten es un inhibidor de miosina esquelética rápida de primera clase administrado oralmente, diseñado para proteger contra el daño muscular inducido por la contracción en distrofias musculares, incluyendo Becker y Duchenne. Sevasemten presenta un mecanismo de acción novedoso diseñado para limitar selectivamente el daño muscular exagerado causado por la ausencia o pérdida de distrofina funcional. Su mecanismo de acción único ofrece el potencial para establecerse como una terapia de base en distrofinopatías (distrofias relacionadas con la distrofina), ya sea como una terapia de un solo agente, o en combinación con terapias disponibles y aquellas en desarrollo. Sevasemten ha logrado hitos regulatorios notables al obtener la Designación de Medicamento Huérfano por la FDA para el tratamiento de Becker y Duchenne, la Designación de Enfermedad Pediátrica Rara (RPDD, por sus siglas en inglés) para el tratamiento de Duchenne, y las designaciones de vía rápida para el tratamiento de Becker y Duchenne. Además, sevasemten obtuvo la Designación de Medicamento Huérfano por la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) para el tratamiento de Becker y Duchenne.
Sobre Becker
Becker es un trastorno neuromuscular raro, genético, degenerativo y debilitante, y que acorta la esperanza de vida. Las mutaciones genéticas en el gen de la distrofina resultan en daño muscular inducido por la contracción, lo cual es el factor principal de la pérdida muscular irreversible y del daño a la función motora. Esta enfermedad afecta de forma predominante a los hombres, comenzando con el deterioro funcional a cualquier edad. Una vez que la pérdida muscular ocurre, el deterioro en la función es irreversible y progresa a lo largo de la vida de la persona. Actualmente, no hay terapias aprobadas en el mercado que traten Becker.
Sobre Duchenne
Duchenne es un trastorno muscular degenerativo severo, es el tipo de distrofia muscular más común con un promedio de esperanza de vida de alrededor de 30 años. Las mutaciones genéticas en el gen de la distrofina resultan en daño muscular inducido por la contracción, lo cual es el factor principal de la pérdida muscular irreversible y el daño a la función motora. Aunque existen terapias aprobadas en el mercado orientadas a tratar la enfermedad, aún hay una gran necesidad no cubierta de terapias adicionales.
Sobre Edgewise Therapeutics
Edgewise Therapeutics es una compañía biofarmacéutica líder en enfermedades musculares que desarrolla terapias novedosas para distrofias musculares y condiciones cardiacas severas. La profunda experiencia de la Compañía en fisiología muscular impulsa una nueva generación de novedosas terapias. Sevasemten es un inhibidor de miosina esquelética rápida administrado oralmente en ensayos clínicos de última fase para las distrofias musculares de Becker y Duchenne. EDG-7500 es un novedoso modulador del sarcómero cardíaco para el tratamiento de la miocardiopatía hipertrófica y otras enfermedades de disfunción diastólica, actualmente en desarrollo clínico de Fase 2. Todo el equipo de Edgewise se dedica a nuestra misión: cambiar las vidas de pacientes y familias afectados por enfermedades musculares severas. Para saber más, puede visitar: www.edgewisetx.com o seguirnos en LinkedIn, X, Facebook e Instagram.
Referencias
[1] Bello L, et al. Functional changes in Becker muscular dystrophy: implications for clinical trials in dystrophinopathies. Sci Rep. 2016;6:32439. doi:10.1038/srep32439
[2] van de Velde NM, et al. Selection approach to identify the optimal biomarker using quantitative muscle MRI and functional assessments in Becker muscular dystrophy. Neurology. 2021;97(5):e513-e522. doi: 10.1212/WNL.0000000000012233.
[3] De Wel B, et al. Lessons for future clinical trials in adults with Becker muscular dystrophy: disease progression detected by muscle magnetic resonance imaging, clinical and patient-reported outcome measures. Eur J Neurol. 2024:e16282. doi:10.1111/ene.16282. En línea antes de impreso.
[4] Muntoni F, et. al., Neuromuscul Disord., 2022 Apr;32(4):271-283. doi: 10.1016/j.nmd.2022.02.009
Nota aclaratoria sobre declaraciones a futuro
Este comunicado de prensa contiene declaraciones a futuro, tal como se define dicho término en la Sección 27A de la Ley de Valores de 1933 y Sección 21E de la Ley de Intercambio de Valores de 1934. Las declaraciones en este comunicado de prensa que no son meramente históricas son declaraciones a futuro. Dichas declaraciones a futuro incluyen, entre otras cosas, declaraciones sobre el potencial y expectativas relacionadas con sevasemten; declaraciones sobre la posible oportunidad comercial de sevasemten; declaraciones sobre los hitos y expectativas de Edgewise en relación a sus ensayos clínicos y desarrollo clínico de sevasemten, incluyendo el tiempo estimado de los datos importantes para el ensayo GRAND CANYON y el tiempo estimado para el inicio del estudio pivotal de sevasemten; declaraciones en relación al posible resultado del ensayo GRAND CANYON; declaraciones en relación al cronometraje y resultado del diálogo de Edgewise con la FDA; declaraciones en relación a la vía clara hacia el posible registro de sevasemten como la primer terapia para Becker; y declaraciones hechas por el Presidente, Director General y Director Médico de Edgewise. Palabras como “cree”, “anticipa”, “planea”, “espera”, “pretende”, “objetivo”, “será”, “potencial”, y expresiones similares, están orientadas a identificar declaraciones a futuro. Las declaraciones a futuro contenidas aquí se basan en las expectativas actuales de Edgewise e involucran suposiciones que pudieran nunca materializarse o probarse incorrectas. Los resultados reales pudieran diferir materialmente de aquellos proyectados en declaraciones a futuro debido a numerosos riesgos e incertidumbres, incluyendo pero no limitado a: riesgos asociados con el historial operante limitado de Edgewise; sus productos en etapas tempranas de desarrollo y no contar con productos aprobados para venta comercial; riesgos asociados con la falta de generación de réditos de Edgewise a la fecha; la capacidad de Edgewise de lograr objetivos relacionados con el descubrimiento, desarrollo y comercialización de sus productos candidatos, en caso de ser aprobados; la necesidad de Edgewise de capital adicional sustancial para financiar sus operaciones; la dependencia sustancial de Edgewise del éxito de sevasemten; la capacidad de Edgewise de desarrollar y comercializar sevasemten y descubrir, desarrollar y comercializar productos candidatos en programas futuros; riesgos relacionados con no demostrar seguridad y eficacia en los ensayos clínicos de Edgewise de sus productos candidatos; riesgos relacionados con causar eventos adversos severos, toxicidades, o algún otro efecto secundario no deseado con los productos candidatos de Edgewise; el resultado de las pruebas preclínicas y ensayos clínicos tempranos resultaran no siendo predictivos del exito de ensayos clínicos posteriores y que los riesgos relacionados con los resultados de los ensayos clínicos de Edgewise no cumplieran los requisitos de las autoridades regulatorias; retrasos o dificultades en la inscripción y/o mantenimiento de pacientes en ensayos clínicos; riesgos relacionados a la incapacidad de capitalizar en otras indicaciones o productos candidatos, riesgos relaciones con la competencia; riesgos relacionados con cambios en los datos provisionales, importantes y preliminares de los ensayos clínicos de Edgewise, conforme más datos de pacientes se encuentren disponibles; riesgos relacionados con que los procesos de aprobación regulatorios de autoridades locales y extranjeras resultaran extensos, prolongados e inherentemente impredecibles; riesgos relacionados con la producción de medicinas por manufactureras de terceras personas para Edgewise; riesgos relacionados con cambios en los métodos de manufacturación o formulación de productos candidatos; riesgos relacionados con no lograr aceptación adecuada en el mercado; riesgos relacionados a que la población de pacientes de nuestros productos candidatos sea pequeña; riesgos relacionados a la negación de las autoridades regulatorias de los datos provenientes de ensayos clínicos realizados en ubicaciones fuera de su jurisdicción; riesgos relacionados con la capacidad de Edgewise de atraer y retener jefes ejecutivos y empleados altamente calificados; la capacidad de Edgewise de obtener y mantener protegida la propiedad intelectual de sus productos candidatos; la confianza de Edgewise en terceras personas; condiciones comerciales y económicas generales; y otros riesgos. La información sobre riesgos adicionales y precedentes se puede encontrar en la sección “Factores de riesgo” en documentos que Edgewise archiva de vez en cuando con la Comisión de Bolsa y Valores de EE. UU. Estas declaraciones a futuro se hacen a la fecha de este comunicado de prensa, y Edgewise no asume obligación alguna de actualizar las declaraciones a futuro, o de actualizar las razones de por las que los resultados reales pudieran diferir de aquellos proyectados en las declaraciones a futuro, a menos de ser requerido por la ley.
Este comunicado de prensa incluye hipervínculos a información que no se considera incorporada por referencia al presente comunicado.
Para ver el contenido original y descargar contenido multimedia: https://www.prnewswire.com/news-releases/edgewise-therapeutics-reports-positive-results-on-sevasemten-program-for-becker-and-duchenne-muscular-dystrophies-302491562.html
FUENTE Edgewise Therapeutics
